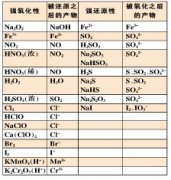
1、学习离子反应之前要了解电解质和非电解质:在水溶液里或熔融状态下能够导电的化合物叫做电解质;在水溶液里或熔融状态下都不能电离的化合物叫非电解质;常见的电解质和非电解质:电解质一般包含:酸、碱、盐、活泼金属氧化物等;非电解质:非金属氧化物(CO2、SO2等)、某些非金属氢化物(如NH3)、绝大多数有机物。
2、电解质又分强、弱电解质:强电解质是指在水分子作用下,能完全电离为离子的电解质。包括大多数盐类、强酸、强碱、部分碱性氧化物等。弱电解质是指在水分子作用下,只有部分分子电离的电解质。包括弱酸(如HAc、H2S)、弱碱(如NH3·H2O) 、Al(OH)3、H2O等。因此强弱电解质的电离程度大不相同。
3、离子反应:有离子参加的反应,知道常见的离子反应的类型,离子反应发生的条件,离子共存的条件。
4、离子方程式:用实际参加反应的离子符号表示离子反应的式子。通过书写离子方程式,我们知道多个具体的反应写出的离子方程式是一样的。这说明:离子方程式不仅可以表示某一具体的化学反应,而且还可以表示同一类型的离子反应。离子方程式的意义:表示了反应的实质,代表了同一类型的离子反应。
常见考法
本知识常以选择题的形式考查电解质的分类、强弱电解质的电离程度、弱电解质的电离平衡、离子方程式的书写方法,考查的难度居中,一般掌握以上基础知识即可解决。
误区提醒
1. 电解质必须是化合物,而化合物不一定是电解质;
2. 电解质导电是有条件的:水溶液或熔融状态下;
3. 电解质必须是在上述条件下自身电离出离子的化合物;
4. 能导电的物质不一定是电解质,例如金属能导电,但不是化合物;
5. 单质、混合物既不是电解质也不是非电解质。
【典型例题】
例:下列反应的离子方程式正确的是
A.钠与水的反应:Na+H2O=Na++OH-+H2↑
B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
C.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe++Cu=Fe2++Cu2+
解析:
钠与水的反应:Na+H2O=Na++OH-+H2↑H原子个数不平,故A错;氯气与水反应:Cl2+H2O=2H++Cl-+ClO-中HClO是弱酸,在离子方程式中不能拆,故B错;氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O,C对;用FeCl3溶液腐蚀印刷电路板:Fe++Cu=Fe2++Cu2+电荷不等,故D错。
答案:C
随机阅读
- [高考化学备考] 怎样掌握高中化学学习方法
- [高考化学备考] 化学解决计算题失分的步骤
- [高考化学备考] 高考化学知识点:常见的氧
- [高考化学备考] 高中化学学习中总结的四个
- [高考化学备考] 高三化学知识点 化学反应
- [高考化学备考] 高考化学复习指导:轻重分
- [高考化学备考] 高考化学知识点:带颜色的
- [高考化学备考] 怎样做化学元素推断题
- [高考化学备考] 理综化学大题高分技巧
- [高考化学备考] 高中化学离子方程式判断
- [高考化学备考] 高中化学方程式总结
- [高考化学备考] 高考化学学习防范:化学知
- [高考化学备考] 高中化学易错知识点
- [高考化学备考] 高考化学复习方法: 改变
- [高考化学备考] 高三化学知识点 电解质
- [高考化学备考] 化学教学中渗透绿色化学教